
原发免疫性血小板减少症(ITP)是一种获得性自身免疫性出血性疾病,以无明确诱因的孤立性外周血血小板计数减少为主要特点。临床表现为无症状血小板减少、皮肤粘膜出血、严重内脏出血甚至致命性颅内出血。
经过多年的科学研究与临床应用,ITP的诊断与治疗也有新的进展。具体都有了哪些新思路、新流程呢?那么就让我们跟着山东大学齐鲁医院血液科石艳教授一起“捋捋清”!

病例一:
患者,女,28岁,因“诊为ITP6年,加重1月“于2018.06.04入院。6年前因反复鼻衄,查血发现PLT减少(9~29×109/L)诊断为ITP,给予大剂量地塞米松冲击治疗,效果可,1年前患者怀孕后血小板再次下降,妊娠期间口服泼尼松15~30mg治疗,血小板波动于3~14×109/L,2个月前给予大剂量丙种球蛋白治疗,血小板升至51×109/L,患者顺利分娩1子,1月无明显诱因的阴道出血量增加,伴头晕乏力。
➢血常规:WBC 7.73×109/L,RBC 1.68×1012/L,Hb 47g/L,PLT 5×109/L。
➢风湿系列:抗核抗体谱+抗磷脂抗体+抗中性粒细胞胞浆抗体、甲状腺功能及抗体均阴性。
➢病毒筛查:乙肝五项及丙肝抗体均为阴性。HIV、CMV、EBV阴性。
➢骨髓穿刺:巨核细胞156个,符合ITP。染色体:正常核型。
➢诊断:1. 原发免疫性血小板减少症
(ITP)
2.重度贫血
➢分期:持续性ITP(确诊后3~12个月血小板持续减少)
➢治疗:rhTPO+地西他滨(2018.06.08,2018.07.02,2018.07.19),效果不佳,参与海曲泊帕临床试验,效果可。试验结束后血小板再次下降并月经增多,口服艾曲泊帕25mg qd治疗,效果可。
患者于2021.05.18因“意识不清半小时”入神经内科急诊治疗。
➢血常规:WBC 11.0×109/L,Hb 126g/L,PLT 12×109/L。
➢颅脑CT:脑梗塞
➢风湿系列:抗核抗体1:80+,类风湿因子 69.06 IU/mL,抗磷脂抗体IgA 18.40 U/mL,IgG 22 U/mL,抗β2糖蛋白1抗体IgA 15.5 RU/mL,IgG 106.9 RU/mL
➢诊断:1.抗磷脂抗体综合征
2.继发免疫性血小板减少症
病例二:
患者,男,25岁,因“自幼鼻衄,发现血小板减少”就诊。患者自幼鼻衄,查血发现血小板减少,最低2×109/L,诊断为ITP,曾用激素、丙球、他克莫司等治疗,效果差,应用艾曲泊帕治疗血小板可升至正常,近来血小板再次下降至38×109/L。
➢无家族史
➢风湿系列:抗核抗体谱+抗磷脂抗体+抗中性粒细胞胞浆抗体、甲状腺功能及抗体、乙肝五项及丙肝抗体均为阴性。HIV、CMV、EBV阴性均阴性。
➢骨髓穿刺:巨核细胞108个,成熟障碍。染色体:正常核型。
➢诊断:遗传性血小板减少症

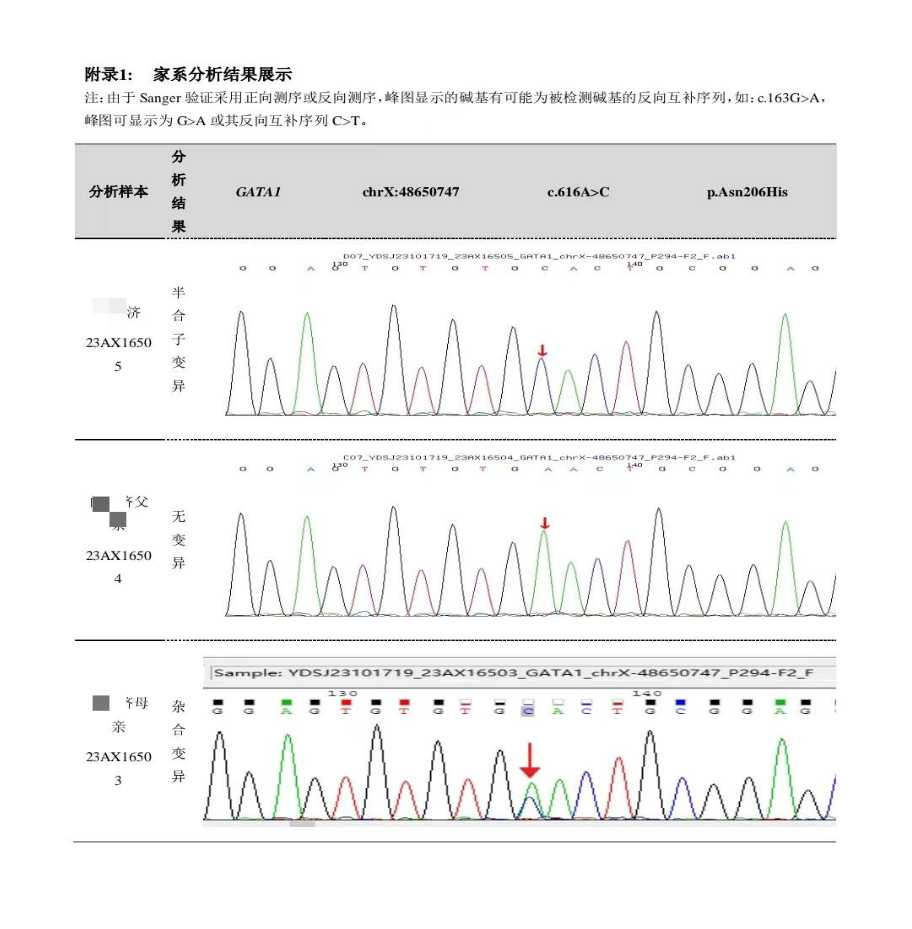
病例三:
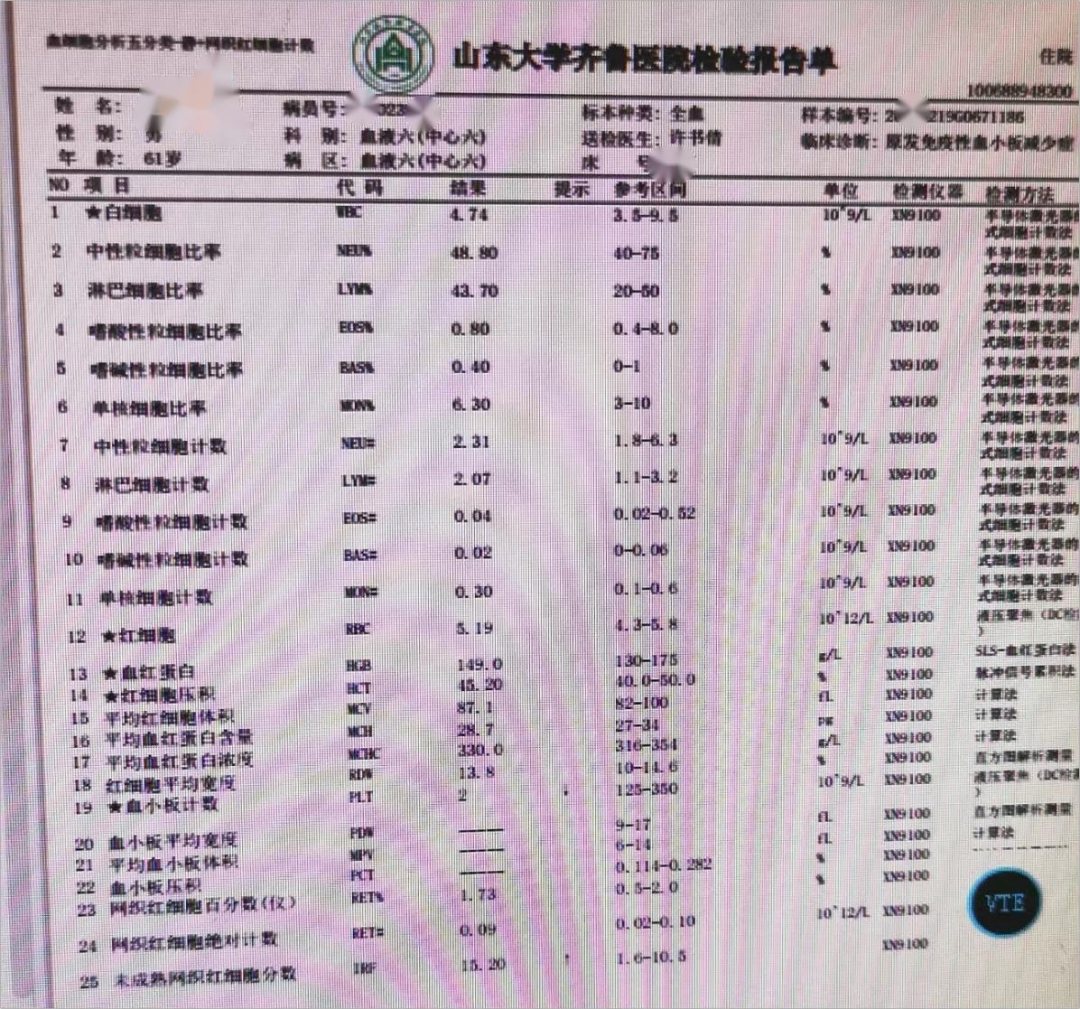
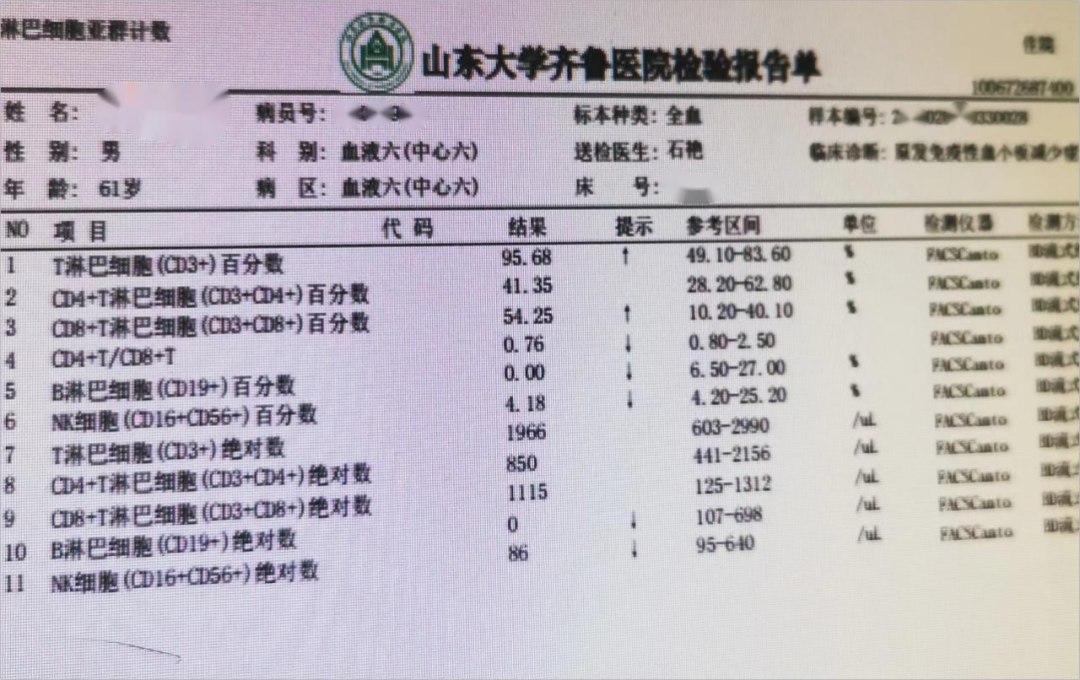
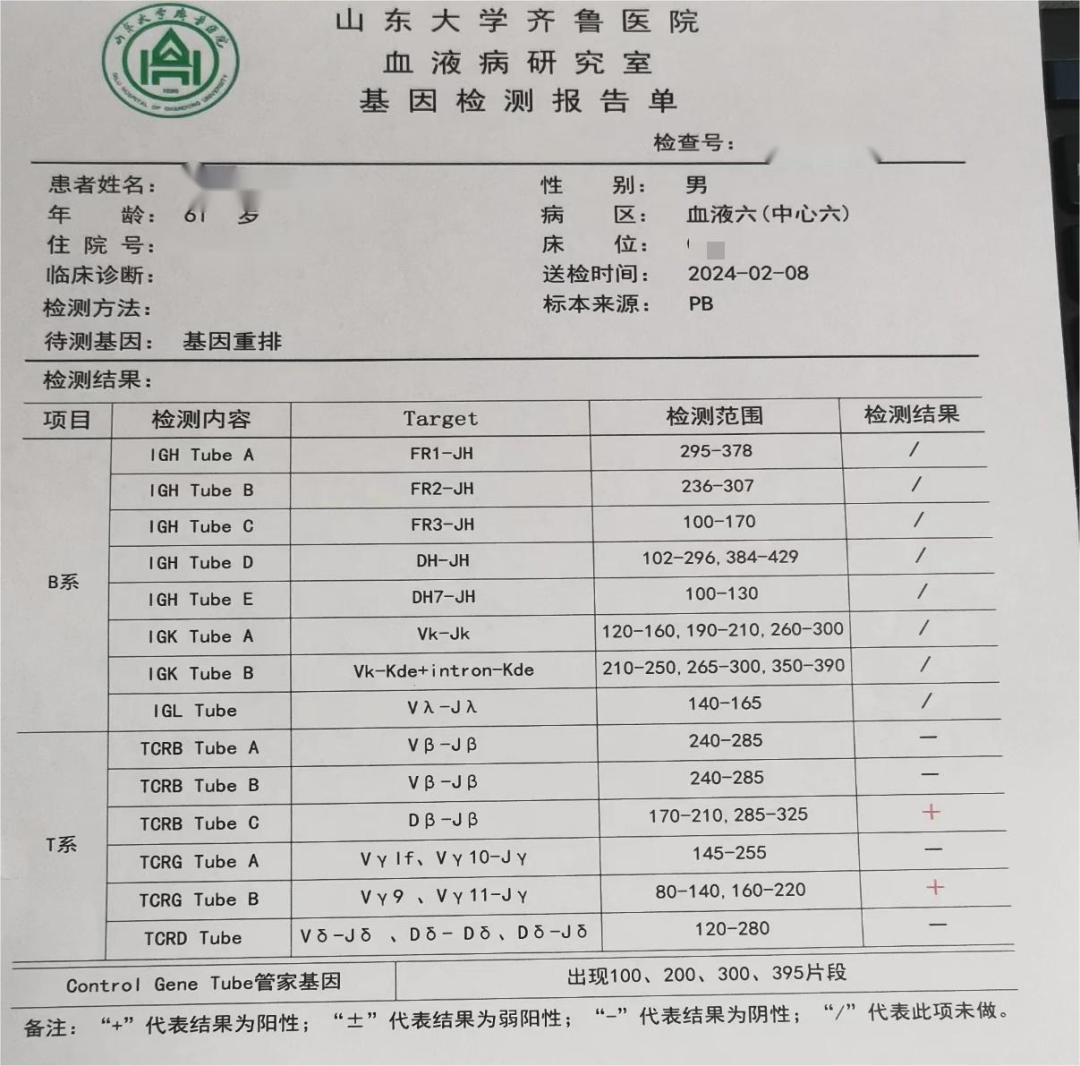
患者,男,61岁,因“发现血小板减少4月余,间断便血2月“就诊。4个月前因皮肤紫癜去当地医院就诊,查血发现血小板2×109/L,风湿免疫、病毒相关检查均阴性,骨髓细胞学增生活跃,巨核细胞429个,以颗粒型巨核细胞为主,诊断为ITP。给予激素、升血小板胶囊等治疗,血小板升至63×109/L,激素减量后再次下降,加用达那唑、艾曲泊帕50mg、双醋瑞因治疗,血小板回到正常,但激素减到15mg/d,血小板再次下降,并出现便血,艾曲泊帕升至75mg/d,无效,改为阿伐曲波帕20mg qd,治疗3周仍无效,入我院。
➢无家族史
➢风湿系列:抗核抗体谱+抗磷脂抗体+抗中性粒细胞胞浆抗体、甲状腺功能及抗体、乙肝五项及丙肝抗体均为阴性。HIV、男性肿瘤系列均阴性。
➢诊断:1.大颗粒淋巴细胞白血病
2.继发性免疫性血小板减少

那么以上这三位患者下一步该如何诊断、治疗呢?
目前,ITP的诊断仍基于临床排除法,需除外其他原因所致血小板减少,在诊断前对疑似ITP患者进行全面评估。诊断要点包括:
- 详细询问病史及细致体检;
- 至少连续2次血常规检查示血小板计数减少,外周血涂片镜检查血细胞形态无明显异常;
- 脾脏一般不增大;
- ITP患者骨髓细胞形态学特点为巨核细胞增多或正常,伴成熟障碍;
- 须排除其他继发性血小板减少症;
- 进行诊断ITP的特殊实验室检查;
- 进行出血程度分级评估。
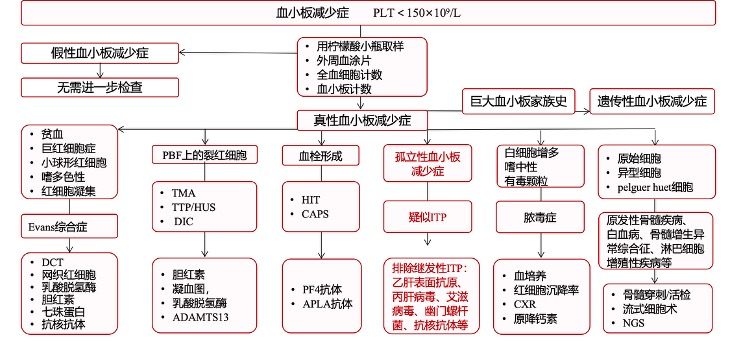
ITP诊断流程
目前,成人ITP诊断和治疗流程也有了更新。在2020版中华医学会ITP诊疗流程的基础上,侯明教授也提出了新的2023版ITP诊疗流程[1]:
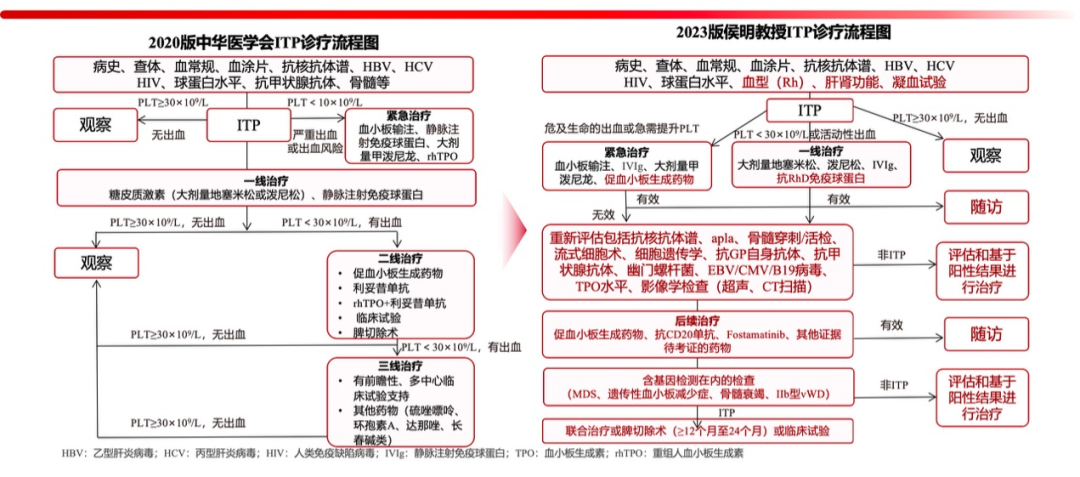
在2023版ITP诊疗流程图中,将治疗分为紧急治疗、一线治疗与后续治疗。
一、紧急治疗:
当ITP患者存在危及生命出血或需要急症手术,应迅速提升血小板至安全水平时,需进行紧急治疗。
➢可单用或联合应用静脉注射免疫球蛋白(IVIg)1g/kg/d×1~2d、甲泼尼龙1000mg/d×3d和血小板生成素受体激动剂(TPO-RA)进行治疗;
➢可通过血小板输注进行治疗;
➢在IVIg及激素无效、血小板输注无效时,应考虑应用促血小板生成药物;
➢其他治疗措施还包括急症脾切除、控制高血压、口服避孕药控制月经过多、停用抗血小板药物等;
➢情况紧急时可用rh-FVIIa进行紧急止血。
二、一线治疗:
糖皮质激素与静脉输注丙种球蛋白(IVIg)的一线治疗地位仍不可撼动。
➢糖皮质激素治疗可单用大剂量地塞米松(40mg/d×4d,1-2周期)以及泼尼松[剂量1.0mg/(kg·d)×14d,最大剂量80mg/d,2-3周后减量,6周内停用(最长8周)],二者相比,大剂量地塞米松起效更快、完全缓解率更高,安全性也更好[2]。还可大剂量地塞米松与其他药物联合进行治疗,最新进展显示一线联合治疗模式可提高长期疗效。
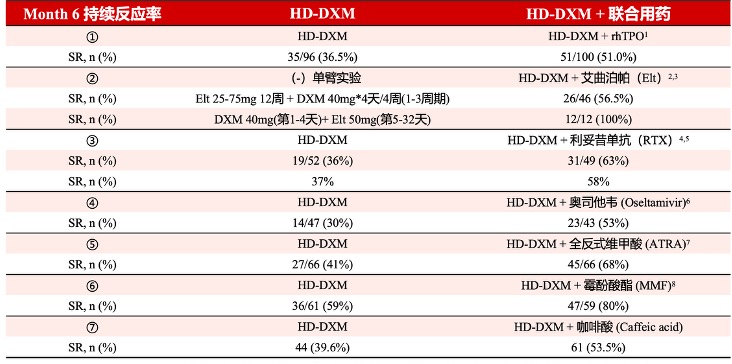
大剂量地塞米松联合用药方案(HD-DXM+X)
新诊断ITP患者初治有效率高,但易复发,约60%~70%的患者会进展为持续性或慢性ITP。而此类初始一线治疗失败的患者需进行后续治疗,使患者血小板达安全值>30×109/L,减少毒副作用。
后续治疗可分为药物治疗和手术治疗。药物治疗包括证据明确的药物,如TPO受体激动剂、利妥昔单抗、福他替尼,此外还有其他治疗药物以及正在进行临床试验的药物;除了药物治疗,还可通过脾切除术进行治疗。
- 证据明确的药物
➢TPO受体激动剂:在TPO受体激动剂的应用过程中,需定期检测不良反应并及时进行管理,若血小板水平波动,可换用其他种类的TPO-RA。减量与停药需注意时机和方法,减停期间需密切监测,若病情复发可尝试重启TPO-RA。
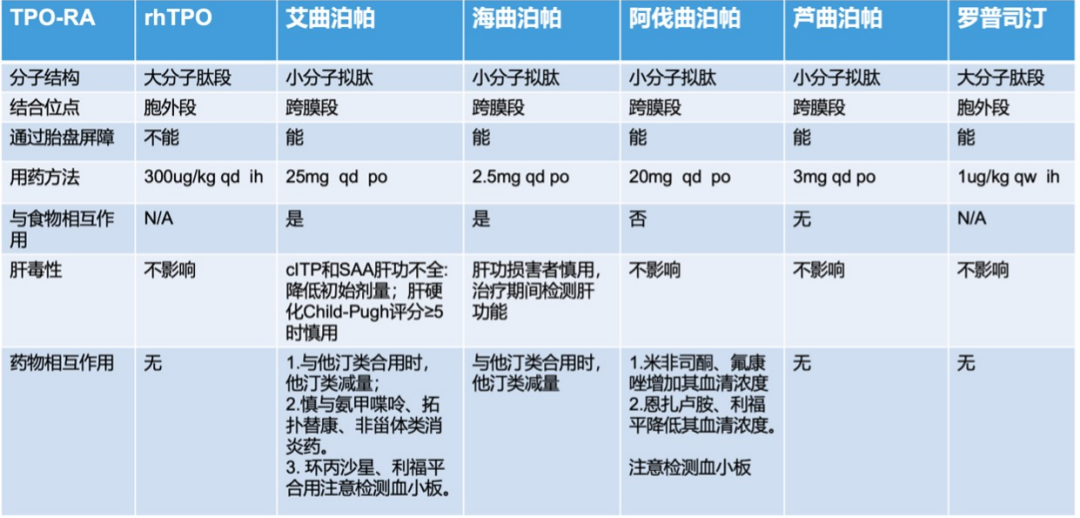
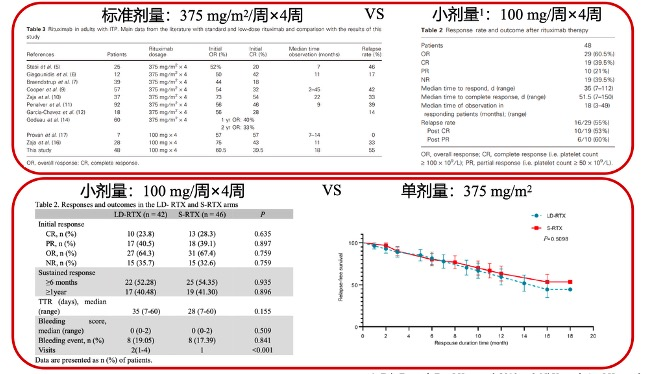
➢利妥昔单抗:标准剂量为375mg/m2/周×4周,小剂量为100mg/周×4周或单剂量375mg/m2,标准剂量利妥昔单抗治疗慢性ITP激素无效患者的有效率与脾切除术相当。利妥昔单抗可能会诱发慢性B细胞衰竭、低γ球蛋白血症、迟发中性粒细胞减少症和进行性多灶性白质脑病,可能增加HBV再激活风险,还可能减弱对某些疫苗的免疫反应。Meta分析表明,利妥昔单抗与其他治疗药物联用可提高其有效率。
利妥昔单抗不同用法比较[4]
➢福他替尼:福他替尼经批准用于其他治疗无效的慢性ITP患者,起始剂量为100mg,每日2次,反应不足的患者可增加至150mg,每日2次。研究显示,福他替尼在难治性ITP患者中的整体有效率约为43%,中位至缓解时间为15天。常见不良反应为高血压、腹泻、恶心和转氨酶升高,一般为轻度至中度,发生率约30%。若用药12周仍无效,应停药。

2.其他治疗药物
后续治疗的其他药物还包括氨苯砜、霉酚酸酯、羟氯喹、硫唑嘌呤、环孢素、达那唑。
其他治疗药物及疗效[5]

- 临床试验药物
目前正在进行临床试验的药物包括BTK抑制剂、FcRn靶向单抗、C1s靶向单抗、HMPL-523等。
跟着石艳教授捋清ITP诊疗新思路,再回到开头的三个病例,下一步的诊断与治疗流程,你有想法了吗?
参考文献:
[1] 中华医学会血液学分会血栓与止血学组, 中华血液学杂志, 2020, 41(8): 617-623;2. .Liu XG, Hou Y, Hou M. J Hematol Oncol. 2023 Jan 19;16(1):4.
[2] Wei Y, et al. Blood. 2016
[3] Peng J, et al. JTH. 2014
[4] 1. Zaja F , et al. Eur J Haematol. 2010 ; 2. Ni X, et al. Am J Hematol. 2022
[5] Choi PY, Merriman E, Bennett A, Enjeti AK, et al. Med J Aust. 2022 Jan 17;216(1):43-52.












回复