专家讲座|郭燕教授分享移植后的隐形危机——血小板“不在岗”!

当造血干细胞把“生命之城”的主干道路全部修通,红绿灯却忽然失灵——负责随时补漏的“焊工”血小板不是迟到,就是罢工,它们居然集体翘班!而城市里任何一条微血管出现“渗水”,都可能瞬间升级为“爆裂事故”。让我们跟随郭燕教授一起探寻——血小板究竟因何缺席,又该怎样召回?
造血干细胞移植是多种血液系统疾病治疗的有效手段,血小板减少是造血干细胞移植后常见并发症,国内外报道发生率为5%~37%。其病因复杂,治疗难度大,是移植的主要不良预后因素之一[1]。
血小板不在岗——是旷工还是罢工?
移植后血小板减少主要分为两类:
1.血小板“旷工”——持续性或持续孤立性血小板减少(PIT),指造血干细胞移植后,外周血中除血小板外的其余血细胞均恢复正常,唯有血小板无明确原因持续低水平(≤80×109/L)超过3个月。
2.血小板“罢工”——继发性血小板恢复失败(SFPR),造血干细胞移植后无输血支持下连续7天血小板水平≥50×109/L,其后出现的连续7天以上血小板水平≤20×109/L或需要输注血小板[2]。
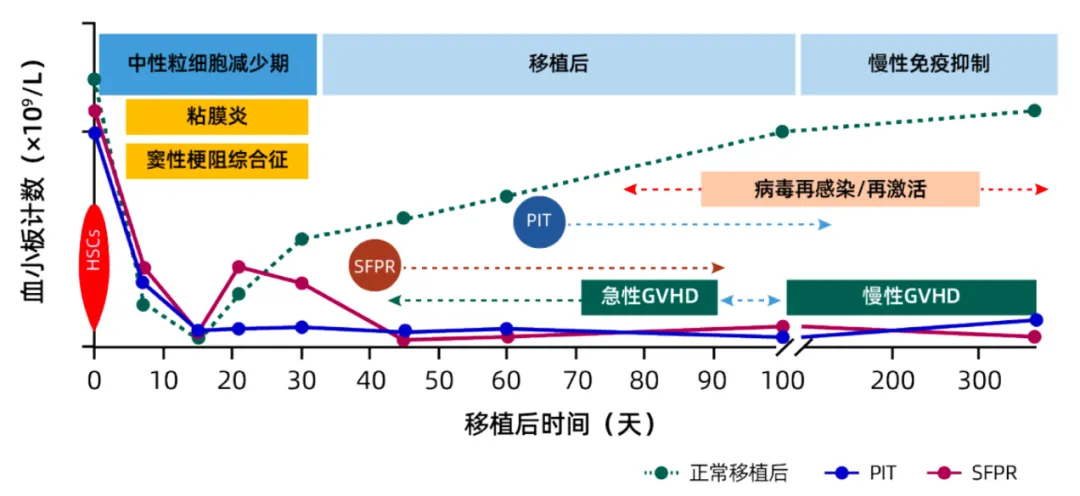
造血干细胞移植后的正常
和异常的血小板植入模式
探寻“返岗障碍”!
造血干细胞移植后血小板减少是如何被触发的?这并非单一机制驱动,而是多因素共同作用的结果。相关危险因素包括急性移植物抗宿主病、移植相关血栓性微血管病、植入不良/失败、巨细胞病毒感染、铁过载等。巨核细胞增殖和前血小板生成是血小板生成的重要阶段,移植后血小板减少的发生机制也主要围绕这方面。
1.免疫微环境异常:移植后免疫系统重建不稳定,异常免疫反应和炎症因子可抑制巨核细胞成熟,并增加血小板的免疫性破坏,尤其在发生移植物抗宿主病时更为明显。
2.血管微环境受损:移植相关内皮损伤破坏骨髓血窦结构,影响前血小板向血流中释放,降低血小板生成效率。
3.血小板生成障碍:巨核细胞数量减少、不成熟比例升高,终末成熟和血小板释放受阻,是血小板减少的核心机制。
4.病理学支持:骨髓检查显示成熟巨核细胞不足,进一步证实血小板生成能力受损[3]。
“双管齐下”
召唤血小板!
2.对症治疗:围绕核心机制,以促进巨核细胞成熟、血小板生成释放及改善患者骨髓微环境为治疗方向,还可通过表观遗传调控药物、间充质细胞输注、抗CD20单抗、细胞因子、输血、供者CD4再回输等方式进行治疗[4]。
•移植后血小板减少常用药物:
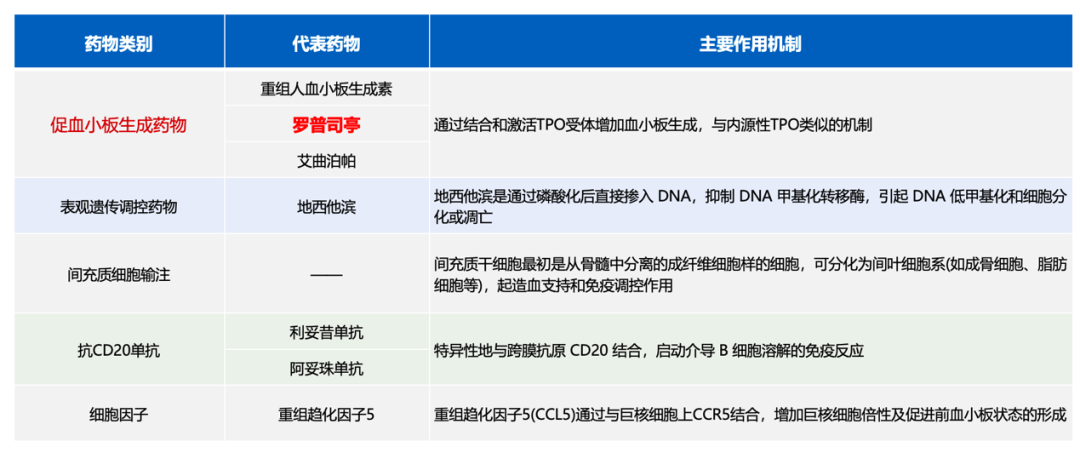
•辅助治疗方案:10×109/L的阈值的血小板在临床上稳定的患者具有可接受预防性血小板输注治疗的安全性;遵循限制性输血策略,并在住院稳定患者中血红蛋白为7~8g/dL时可考虑输血治疗。
从迟到、缺席、不在岗到再次集结,血小板的归队标志着造血干细胞移植后生命之城的安全竣工。血小板重新“在岗”,血管这座地下管网终于恢复最后一道安全阀,移植后的生命之城这才真正完成验收。接下来,就让我们医患并肩,共同守护这座生命之城长治久安!

参考文献:
[1]Bone Marrow Transplant. 2006 Sep;38(5):377-84.
[2]Upendra Mahat, et al. Biol Blood Marrow Transplant. 2020 Mar;26(3):e65-e73.
[3]Chen S , et al. Cell Death & Disease, 2013, 4(7):e722.
[4]黄爱杰, 等. 中国实验血液学杂志, 2017,25(1):270-275.
扫码加入病友群
申请好友时请备注疾病类型
咨询和交流ITP相关问题














回复